Mehr als 1,3 Millionen Menschen sind in Deutschland von einer Demenzerkrankung betroffen. Bereits der deutsche Psychiater und Neuropathologe Alois Alzheimer (1864-1915), nach dem die Demenzerkrankung benannt ist, stellte im Gehirn von verstorbenen Patienten massenhaft zugrunde gegangene Nervenzellen und auffällige Eiweißablagerungen – so genannte „Plaques“ – fest. Er vermutete, dass diese Ablagerungen mit der „Krankheit des Vergessens“ ursächlich im Zusammenhang stehen. „Ein wesentlicher Bestandteil der Plaques ist das Amyloid beta, welches im Gehirn von Alzheimer Patienten vermehrt vorliegt“, berichtet der Sprecher der Forschergruppe Prof. Dr. Michael T. Heneka von der Klinik und Poliklinik für Neurologie des Bonner Universitätsklinikums.
Ein verändertes Eiweiß fördert die Plaquebildung im Gehirn
Dieses Amyloid beta besteht wie auf einer Perlenschnur aufgereiht aus einer Kette von 40 bis 42 Aminosäuren. Davon ist eine einzige - das Tyrosin - an Position zehn der Reihe bei all den Lebewesen zu finden, die im höheren Alter eine Plaquebildung im Gehirn aufweisen. „In der nun veröffentlichten Studie beschreiben wir erstmals eine Veränderung dieses Tyrosins, nachdem es von den Gehirnzellen hergestellt wurde“, berichtet Prof. Heneka. „Dieses Tyrosin fördert die Neigung des Amyloid beta, Plaques zu bilden, und beschleunigt die Ablagerung des Eiweißes.“ Die veränderte Form des Tyrosins entsteht durch Stickoxide. „Es kommt sowohl im Kern der Plaques von älteren Alzheimer-Patienten als auch bei Mäusen mit der Alzheimer-Krankheit vor und scheint so etwas wie der Kondensationskeim für die Ablagerungen zu sein“, sagt der Bonner Neurologe.
Möglicher Ansatz für neue Behandlungsmöglichkeiten
An der Studie waren neben Erstautor Dr. Markus Kummer von der Neurologie des Bonner Universitätsklinikums auch Wissenschaftler aus Braunschweig, Münster und München beteiligt. Die Forscher machen für die Bildung dieser Plaques die Stickoxidsynthase 2 (NOS2) verantwortlich. Es handelt sich dabei um ein Enzym, das durch entzündliche Vorgänge bei der Alzheimer Krankheit stimuliert wird und dann lang anhaltend große Mengen an Stickoxid produziert, das wiederum das Tyrosin verändert. Die Schlüsselrolle des Enzyms fanden die Wissenschaftler in Experimenten heraus. Wenn die Forscher in Mäusen das Gen für NOS2 ausschalteten oder es mit der Substanz „L-NIL“ hemmten, wurde die Gesamtmenge an Amyloid beta als wesentlicher Bestandteil der Plaques drastisch reduziert. „Die Tiere wurden dadurch gleichzeitig vor Lern- und Gedächtnisstörungen geschützt“, berichtet Prof. Heneka. „Dieses Ergebnis legt nahe, dass die Hemmung des NOS2 den Verlauf der Alzheimer-Krankheit nachhaltig verbessern könnte und stellt somit einen potentiell therapeutischen Ansatz dar.“ Ob der Hemmstoff „L-NIL“ tatsächlich eine neue Behandlungsmöglichkeit für Alzheimer-Patienten darstellt, müsse jedoch erst noch in zahlreichen Tests geklärt werden, sagt der Bonner Wissenschaftler.
Publikation: Kummer Markus P., Hermes Michael, Delekate, Andrea, Hammerschmidt Thea, Kumar Sathish, Terwel Dick, Walter Jochen, Pape Hans-Christian, König Simone, Roeber Sigrun, Jessen Frank, Klockgether Thomas, Korte Martin and Heneka Michael T.: Nitration of tyrosine 10 critically enhances amyloid ß aggregation and plaque formation. Fachjournal „Neuron“, DOI 10.1016/j.neuron.2011.07.001
Kontakt:
Prof. Dr. Michael T. Heneka
Klinik und Poliklinik für Neurologie
Tel. 0228/28713092
Mobil: 0151/582 332 87
michael.heneka@ukb.uni-bonn.de
Schutz vor der Alzheimer-Erkrankung Schutz vor der Alzheimer-Erkrankung
Forscher der Universität Bonn finden einen Weg, gefährliche Ablagerungen im Gehirn zu unterbinden
Ein Forscherteam unter Federführung der Universität Bonn hat einen Mechanismus entdeckt, der vor der Alzheimer-Krankheit schützen kann. Die Wissenschaftler hemmten bei Mäusen die Ausbildung von Ablagerungen aus fehlgefalteten Eiweißstoffen, die für die Lern- und Gedächtnisstörungen von Alzheimer-Patienten mitverantwortlich sind.
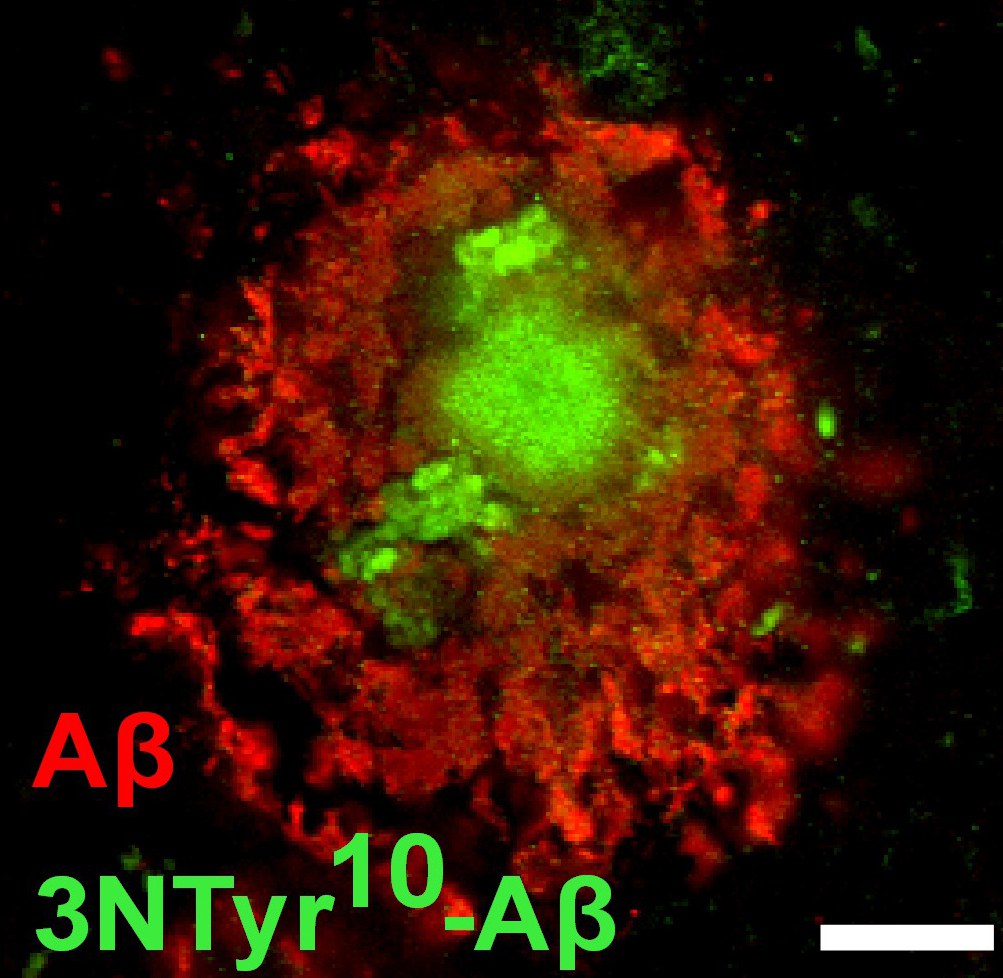
Eiweißablagerungen im Gehirn eines Menschen:
- Grün dargestellt ist nitriertes und rot nicht nitriertes Amyloid beta in den Plaques.
© Foto: Markus Kummer/Henekalab/Uni Bonn
Alle Bilder in Originalgröße herunterladen
Der Abdruck im Zusammenhang mit der Nachricht ist kostenlos, dabei ist der angegebene Bildautor zu nennen.


