Schon länger werden Lichtsignale eingesetzt, um auf DNA-Ebene die Transkription der Erbinformation – und folglich auch die von RNA-Molekülen bewirkte Proteinsynthese – zu verändern. Dieser Ansatz ist ein Teil der Optogenetik und stellt mittlerweile eine fest etablierte Methode der Molekular- und Zellbiologie dar. Die neue Studie zeigt nun aber erstmals einen Mechanismus auf, wie sich die Interaktion zwischen RNA und benachbarten spezifischen Proteinen durch Licht beeinflussen lässt. Die Genexpression in Bakterien kann so direkt auf der Ebene der RNA-Moleküle (engl. Ribonucleic Acids) gesteuert werden.
Den Forschern um Prof. Dr. Andreas Möglich in Bayreuth und Prof. Dr. Günter Mayer in Bonn ist der Nachweis gelungen, dass dieser Mechanismus auf die Zellen von Säugetieren übertragbar ist. „In den nächsten Jahren wollen wir unsere Erkenntnisse zu einer lichtgesteuerten, bei der RNA ansetzenden Regulierung diverser zellulärer Prozesse weiter vertiefen. Daraus resultierende, bis dato nicht zur Verfügung stehende Werkzeuge werden die Untersuchung zentraler zellulärer Vorgänge ungemein befördern. Der Grundstein für die Optoribogenetik, eine neuartige Ergänzung der Optogenetik, ist jetzt gelegt“, sagt Prof. Dr. Andreas Möglich.
Fahndung nach einem geeigneten Protein, das auf Licht reagiert
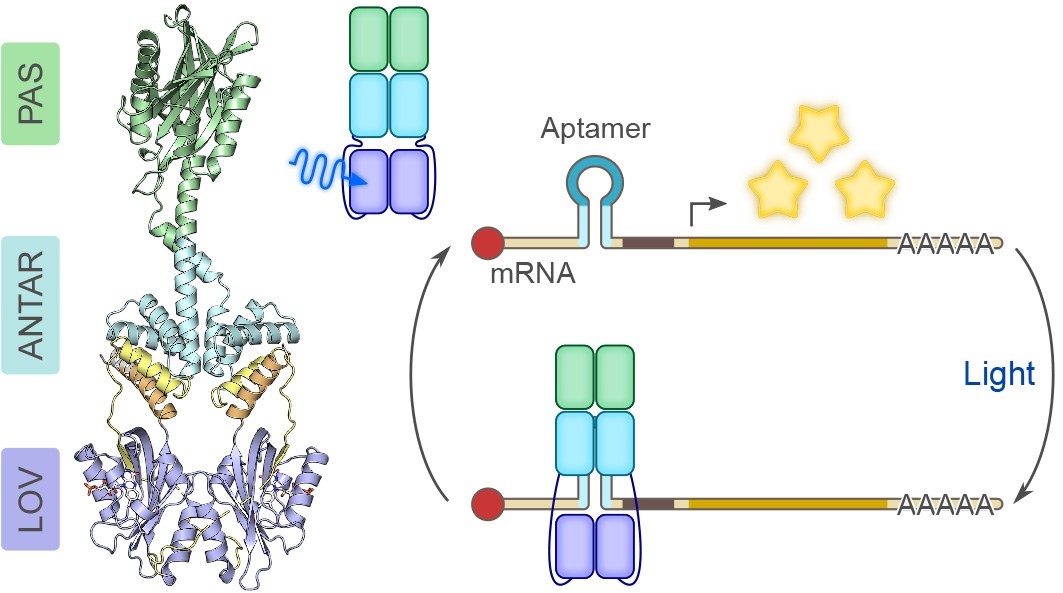
Ausgangspunkt der Forschungsarbeiten war die Suche nach einem bakteriellen Photorezeptorprotein, welches in der Lage ist, unter dem Einfluss von Licht das eigene Bindungsverhalten in Bezug auf RNA zu ändern. Die Wissenschaftler durchsuchten die vorhandenen Sequenz-Datenbanken und wurden fündig. Bakterien der Spezies Nakamurella multipartita enthalten ein Protein mit einer auffälligen dreigliedrigen Architektur: Drei verschiedene Abschnitte – sogenannte Domänen namens „PAS“, „ANTAR“ und „LOV“ – sind darin in einer ungewöhnlichen Reihenfolge hintereinander geschaltet. Wie in Kooperation mit der Arbeitsgruppe von Prof. Dr. Robert Bittl an der Freien Universität Berlin gezeigt werden konnte, reagiert die LOV-Photosensor-Domäne auf blaues Licht und leitet die Signale an die ANTAR-Domäne weiter. Diese verändert daraufhin ihre Struktur dahingehend, dass RNA-Moleküle gebunden und auf diesem Wege unzugänglich gemacht werden: Sie stehen nicht länger für die Genexpression zur Verfügung, die in ihnen enthaltene Erbinformation wird nicht mehr für die Synthese von Proteinen genutzt.
Erst wenn die Blaulicht-Bestrahlung endet und die ANTAR-Domäne wieder in ihre normale Struktur zurückfällt, löst sich die Interaktion mit der RNA. Jetzt wird die RNA wieder aktiv. Die Forscher haben diesen Vorgang zunächst am Beispiel der RNA-Aptameren etabliert und nachgewiesen. Diese sind kleine RNA-Moleküle mit einer haarnadelähnlichen Struktur, die in die unter Blaulicht geöffnete Struktur der ANTAR-Domäne eindringen können und hier gebunden werden. Mayer: „Aptamere funktionieren modular: Sie lassen sich wie mit einem Baukastensystem an andere Einheiten binden.“
Ihren neuen Forschungsansatz haben die Wissenschaftler auch in eukaryotischen Zellen erprobt, in die sie das bakterielle Protein und die RNA-Aptamere zuvor eingeschleust hatten. Auch in diesen Zellen führen die durch Blaulicht ausgelösten Strukturänderungen dazu, dass Boten-RNA-Moleküle an das Protein binden und während dieses Zustands bei der Genexpression ausfallen. „Wir besitzen deshalb jetzt einen Lichtschalter, mit dem sich die zelluläre Aktivität von unterschiedlichsten RNA-Molekülen gezielt ein- und ausschalten lässt“, erklärt Prof. Dr. Günter Mayer vom LIMES-Institut der Universität Bonn.
Sein Bayreuther Kollege Prof. Dr. Andreas Möglich ergänzt: „Der Ansatz zur lichtregulierten Kontrolle lässt sich prinzipiell auf zahlreiche andere RNA-basierte Prozesse, wie beispielsweise die Prozessierung von micro-RNAs und die damit verknüpfte Gen-Stillegung, übertragen.“ In Folgestudien wollen die beiden Wissenschaftler mit ihren Arbeitsgruppen untersuchen, inwieweit sich der jetzt entdeckte Mechanismus in Modellorganismen zur Kontrolle der Genexpression anwenden lässt.
Publikation: Anna M. Weber et al.: A blue light receptor that mediates RNA binding and translational regulation. Nature Chemical Biology, DOI: 10.1038/s41589-019-0346-y.
Kontakt:
Prof. Dr. Günter Mayer
LIMES-Institut
Universität Bonn
Tel. +49 (0)228-734808
E-Mail: gmayer@uni-bonn.de
Prof. Dr. Andreas Möglich
Lehrstuhl für Biochemie
Universität Bayreuth
Tel. +49 (0)921-7835
E-Mail: andreas.moeglich@uni-bayreuth.de