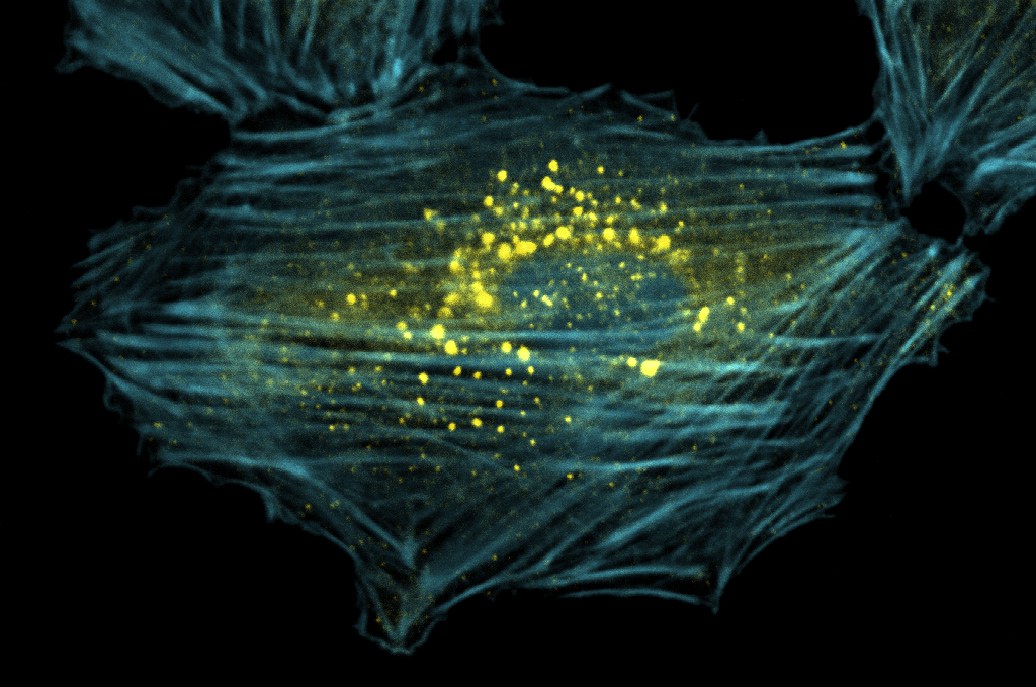
Wer kennt es nicht: Am Auto müssen mal wieder Bremsbeläge und Stoßdämpfer ausgetauscht werden. Aber auch unsere Körperzellen unterliegen einem ständigen mechanischen Verschleiß. Das gilt nicht nur für Muskelzellen, sondern auch für Blut-filtrierende Nierenzellen und Immunzellen, die im Zuge der Immunabwehr unseren Körper durchwandern. „Insbesondere das Protein Filamin wird dabei sehr beansprucht“, sagt Prof. Dr. Jörg Höhfeld vom Institut für Zellbiologie der Universität Bonn. Lebende Zellen verfügen zur Stabilisierung nicht über ein steifes Gerüst, sondern über elastische, fadenförmige Strukturen. Wirken Zugkräfte auf dieses „Skelett“ der Zelle, dann hält das Filamin als elastischer Kleber die Bestandteile zusammen.
Schäden werden durch molekulare „Anstandsdamen“ erkannt
Molekulare „Anstandsdamen“ – sogenannte Chaperone – kontrollieren, ob die Proteine richtig gefaltet sind. Sie erkennen deshalb auch Schäden am Filamin und aktivieren seine Entsorgung in der Zelle. Eine wichtige Rolle beim Abbau spielt ein Chaperon-Helfer, der in Säugetieren „BAG3“ genannt wird. Er ist dafür verantwortlich, dass das „Bitte entsorgen!“-Etikett an das verschlissene Filamin geheftet wird. Dies führt zu einer Entsorgung des Verschleißteils in einem Vorgang der als Chaperon-assistierte selektive Autophagie (CASA) bezeichnet wird. Um diesen Entsorgungsvorgang besser zu verstehen, hat Prof. Höhfeld zusammen mit Forschern der Charité-Universitätsmedizin Berlin nach Kooperationspartnern von BAG3 gesucht. An den Untersuchungen waren außerdem Wissenschaftler des Forschungszentrums Jülich, des Universitätsklinikums Frankfurt und der Universität Kiel beteiligt.
Proteinpartner passen zueinander wie ein Schlüssel ins Schloss
Die Wissenschaftler nutzten bei der Partnersuche für das BAG3 eine physikalisch-chemische Grundregel aus: Proteine, die miteinander interagieren, passen genau wie Schlüssel und Schloss zusammen. „Wir testeten rund 2.500 verschiedene `Schlüssel´“, berichtet Prof. Höhfeld. Dabei wurden nicht nur neue Bestandteile der Entsorgungsmaschinerie entdeckt, sondern auch die entscheidenden Komponenten, die für eine Neubildung des Filamins verantwortlich sind.
Mutationen in einem Gen führen zur tödlichen Muskelschwäche
„Diese Maschinerie sorgt dafür, dass sich der Abbau und der Aufbau des Zellklebers die Waage halten“, berichtet Prof. Höhfeld. Signal für diese Prozesse ist jeweils die mechanische Belastung des Zellskeletts. Damit haben die lebenden Zellen etwas erfunden, wovon jeder Autobesitzer träumt: Sobald ein wichtiges Verschleißteil kaputt geht, rückt automatisch der Wartungstrupp an und tauscht das schadhafte Teil aus. Dies funktioniert aber nicht, wenn die Erbanlage für BAG3 krankhaft verändert ist: Dann kommt es beim Menschen zu einer schwerwiegenden Muskelschwäche. Betroffene überleben meist nur wenige Jahre.
Auch Immunzellen nutzen das Wartungssystem
Zusammen mit Prof. Dr. Waldemar Kolanus vom LIMES-Institut der Universität Bonn zeigten die Forscher, dass nicht nur Muskelzellen, sondern auch Immunzellen den CASA-Mechanismus nutzen. Immunzellen lassen sich mit dem Blutstrom zum Ort einer Infektion oder Entzündung treiben. Dann heften sie sich an die Wand des Blutgefäßes und wandern von dort aus in das betroffene Gewebe. Im Blutstrom müssen die Immunzellen einem sehr großen Druck widerstehen, der sie stark verformt. „Wir konnten zeigen, dass auch in Immunzellen die Entsorgung und Neubildung des Klebeproteins absolut notwendig ist“, berichtet Prof. Kolanus. Wird zum Beispiel die Entsorgung des Filamins durch eine Substanz gehemmt, können sich die Immunzellen nicht mehr anheften und wandern kaum noch. Interessanterweise sind die beteiligten Proteine auch bereits als Regulatoren bei der Krebsentstehung beschrieben worden, bei der ebenfalls mechanische Signale eine wichtige Rolle spielen. „Das deutet darauf hin, dass die CASA-Proteinmaschinerie als therapeutische Zielstruktur bei der Tumorbehandlung dienen könnte“, sagt Prof. Höhfeld. Die Forscher sind davon überzeugt, dass sie ein grundsätzliches Erhaltungsprinzip lebender Zellen entdeckt haben.
Publikation: Cellular Mechanotransduction Relies on Tension-induced an Chaperone-assisted Autophagy, „Current Biology“, DOI: 10.1016/j.cub.2013.01.064
Kontakt:
Prof. Dr. Jörg Höhfeld
Institut für Zellbiologie
Tel. 0228/735308
hoehfeld@uni-bonn.de