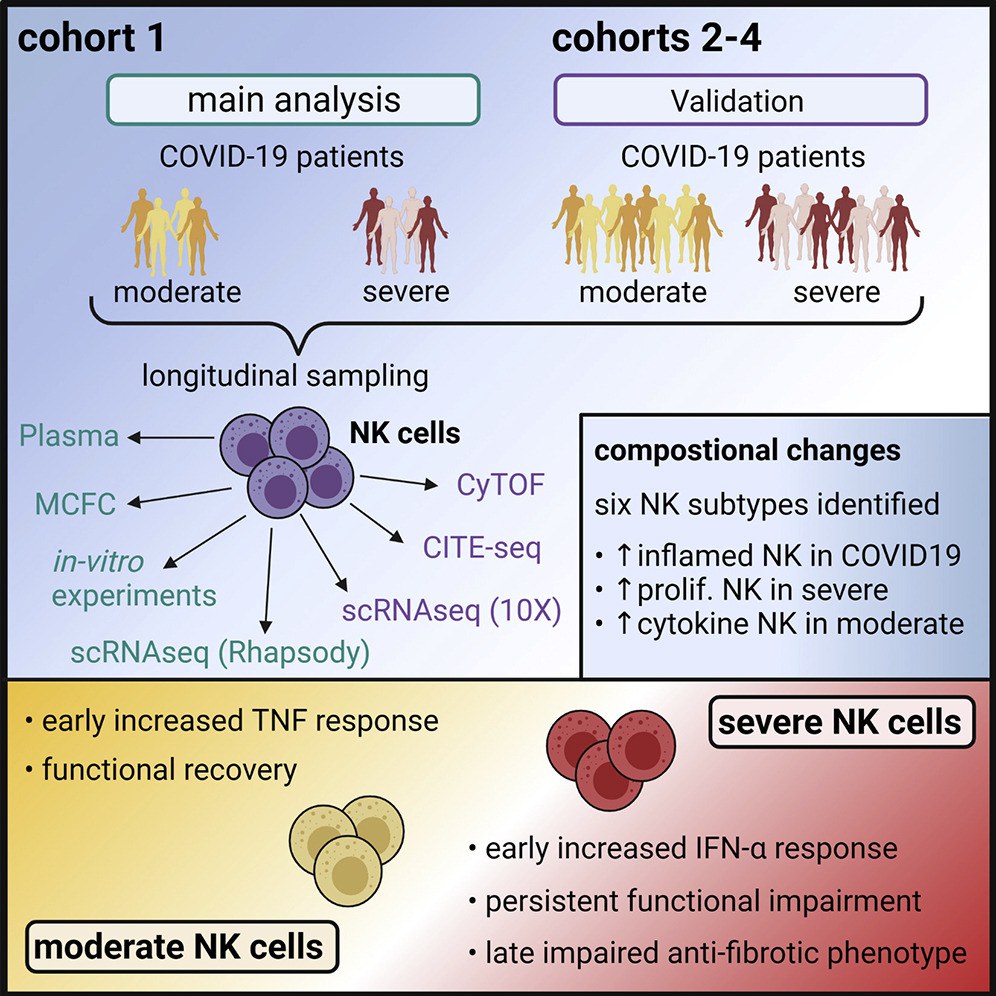
Bisher war unklar, inwieweit natürliche Killerzellen zur Entstehung und Entwicklung bei schwerer COVID-19 Infektion beitragen. Forschende der Universität Bonn und des DZNE konnten nun zusammen mit einem internationalen Team in einer Multicenter-Studie die Rolle von NK-Zellen im Verlauf bei COVID-19 im Detail untersuchen.
Anhaltende Fehlfunktion bei schweren COVID-19 Verläufen
„Bereits im sehr frühen Stadium einer schweren Infektion zeigen NK-Zellen einen spezifischen, molekularen Fingerabdruck, der auf einen Einfluss von sogenannten Typ-I-Interferonen zurückzuführen ist. Begleitet wird das von einer beträchtlichen Funktions-Störung, die über mehrere Wochen anhält“, sagt Prof. Dr. Jacob Nattermann, Studien-Leiter und Leiter der Hepatogastroenterologie der Medizinischen Klinik und Poliklinik I am Universitätsklinikum Bonn (UKB).
Die Forschenden untersuchten in regelmäßigen Abständen Blutproben von 205 Probandinnen und Probanden teilweise von der ersten bis zur sechsten Woche nach der Infektion. So konnten sie die molekularen Eigenschaften und Funktionen der Zellen im zeitlichen Verlauf einordnen.
„Bei NK-Zellen von COVID-19-Patienten mit moderaten Symptomen zeigte sich am Anfang ebenfalls eine leichte Hemmung der Funktionen, aber dies hat sich nach kurzer Zeit wieder normalisiert“, berichtet Prof. Dr. Joachim Schultze, Co-Leiter der Studie und Direktor der Systemmedizin am DZNE.
NK Zellen verlieren antifibrotische Aktivität
Da eine schwere COVID-19-Infektion meist von einer Gewebevermehrung in der Lunge (Lungenfibrose) begleitet wird und NK-Zellen für ihre antifibrotischen Eigenschaften bekannt sind, wurde auch dieser Aspekt näher untersucht. „Drei Wochen nach Infektion waren bei schweren Verläufen molekulare Muster in den NK-Zellen zu erkennen, die bereits bei anderen Immunzellen im Kontext der Fibrosebildung bekannt sind. Passend dazu haben diese NK-Zellen ihre Kapazität, Gewebevernarbungen zu verhindern, erheblich verloren. Dies hat möglicherweise einen Einfluss auf den Umbau des Bindegewebes in der Lunge“, ergänzt Dr. Anna Aschenbrenner, ebenfalls Co-Leiterin der Studie und am Life & Medical Sciences (LIMES) Institut der Universität Bonn sowie am DZNE tätig.
„Inwieweit diese Ergebnisse einen therapeutischen Ansatz unterstützen, muss in nachfolgenden Studien untersucht werden. Allerdings haben wir hier ein gutes Fundament für das Verständnis von NK-Zellen bei der Entstehung und Entwicklung von COVID-19 geschaffen“, sagt Dr. Benjamin Krämer von der Allgemeinen Inneren Medizin I des UKB, einer der Erstautoren.
Nationales und internationales Zusammenspiel
“Der COVID-19-Notfall hat uns gelehrt, dass die Zusammenarbeit mit einigen der besten Gruppen in Deutschland und weltweit es uns ermöglicht, klinisch wichtige Erkenntnisse in beispiellosem Tempo zu erzielen. Wir werden weiter auf diese Weise an NK-Zellen, aber auch an anderen Zelltypen arbeiten“, kommentieren die Co-Erstautoren Rainer Knoll und Dr. Lorenzo Bonaguro, beide vom DZNE. „Wir erhoffen uns dadurch zeitnah ein besseres Verständnis darüber, wie diese verschiedenen Zellen bei schwerem COVID-19 interagieren, um diese komplizierte Krankheit vollständig zu verstehen”, bemerken weiter die Co-Erstautoren Michael ToVinh und Jan Raabe, beide Doktoranden der Medizinischen Klinik und Poliklinik I am UKB.
Beteiligte Institutionen und Förderung:
Es wirkten weitere nationale sowie internationale Gruppen aus folgenden Zentren mit: Uniklinikum Bonn (PD Dr. Beate Kümmerer), Dr. Florian Schmidt (Prof. Dr. Eicke Latz); Charité Berlin (Prof. Dr. Leif Erik Sander, Prof. Dr. Birgit Sawitzki), Uniklinikum Kiel (Prof. Dr. Philipp Rosenstiel), Uniklinikum Düsseldorf (Prof. Dr. Verena Keitel), Newcastle University (Professorin Dr. Muzlifah Haniffa) sowie die University of Washington (Prof. Dr. James R. Heath). Die Studie wurde aus Mitteln der Deutschen Forschungsgemeinschaft (DFG), des Bundesministeriums für Bildung und Forschung (BMBF), des Deutschen Zentrums für Infektionsforschung (DZIF) sowie des DZNE gefördert.
Publikation: “Early IFN-α signatures and persistent dysfunction are distinguishing features of NK cells in severe COVID-19”, Immunity, DOI: 10.1016/j.immuni.2021.09.002, Link zur Studie:
https://www.sciencedirect.com/science/article/pii/S1074761321003654?via%3Dihub
Kontakt:
Prof. Dr. Jacob Nattermann
Hepatogastroenterologie
Medizinische Klinik und Poliklinik I
Uniklinikum Bonn
Tel.: +49 (0)228 287 -12230
E-Mail: jacob.nattermann@ukbonn.de
Prof. Dr. Joachim Schultze
Direktor Systemmedizin
Deutsches Zentrum für Neurodegenerative Erkrankungen (DZNE)
Tel.: +49 (0) 228 43302-410
E-Mail: joachim.schultze@dzne.de