Der Muskelschwund bei Duchenne wird durch einen Mangel an Dystrophin, einem Protein des Zellskeletts, verursacht. Dystrophin kommt in Wirbeltieren in der Muskelfasermembran vor und ist für die Muskelkontraktion wichtig. Obwohl die Erkrankung in erster Linie auf den Defekt eines einzelnen Gens (DMD Gen) zurückzuführen ist, hat sie als primär neuromuskuläre Erkrankung aber auch weitreichende und komplexe gesundheitsrelevante Auswirkungen auf nichtmuskuläre Gewebe und Organsysteme.
In den letzten Jahren haben die Forschungsgruppen um Prof. Dr. Dieter Swandulla, Physiologisches Institut der Universität Bonn, und Prof. Dr. Kay Ohlendieck, National University of Ireland, Maynooth, mit Hilfe massenspektrometrischer Proteinanalysen (Proteomics) gezeigt, dass bei der Duchenne-Muskeldystrophie in einer Reihe von Organen einschließlich Herz, Gehirn, Niere und Leber sowie auch im Speichel, Serum und Urin Veränderungen der jeweils vorkommenden Gesamtproteine (Proteom) auftreten.
Suche nach erkrankungsspezifischen Markerproteinen
„Proteomics sind ein zuverlässiges und effektives Analyseverfahren, um erkrankungsspezifische Markerproteine zu identifizieren, die Aussagen über den Verlauf der Erkrankung, mögliche therapeutische Angriffspunkte und die Wirksamkeit von therapeutischen Interventionen erlauben“, sagt Seniorautor Prof. Swandulla.
In der aktuellen Studie untersuchten die Wissenschaftler mit Hilfe von Proteomics modellhaft an Mäusen, die unter Duchenne-Muskeldystrophie litten, wie die Skelettmuskulatur und die Milz sich angesichts des Dystrophinmangels gegenseitig beeinflussen. Die Milz spielt bei der Immunantwort eine Schlüsselrolle und befindet sich in der Bauchhöhle in der Nähe des Magens. Sie dient der Vermehrung der zu den weißen Blutkörperchen zählenden Lymphozyten, speichert außerdem Immunzellen vom Typ der Monozyten und sortiert überalterte rote Blutkörperchen aus.
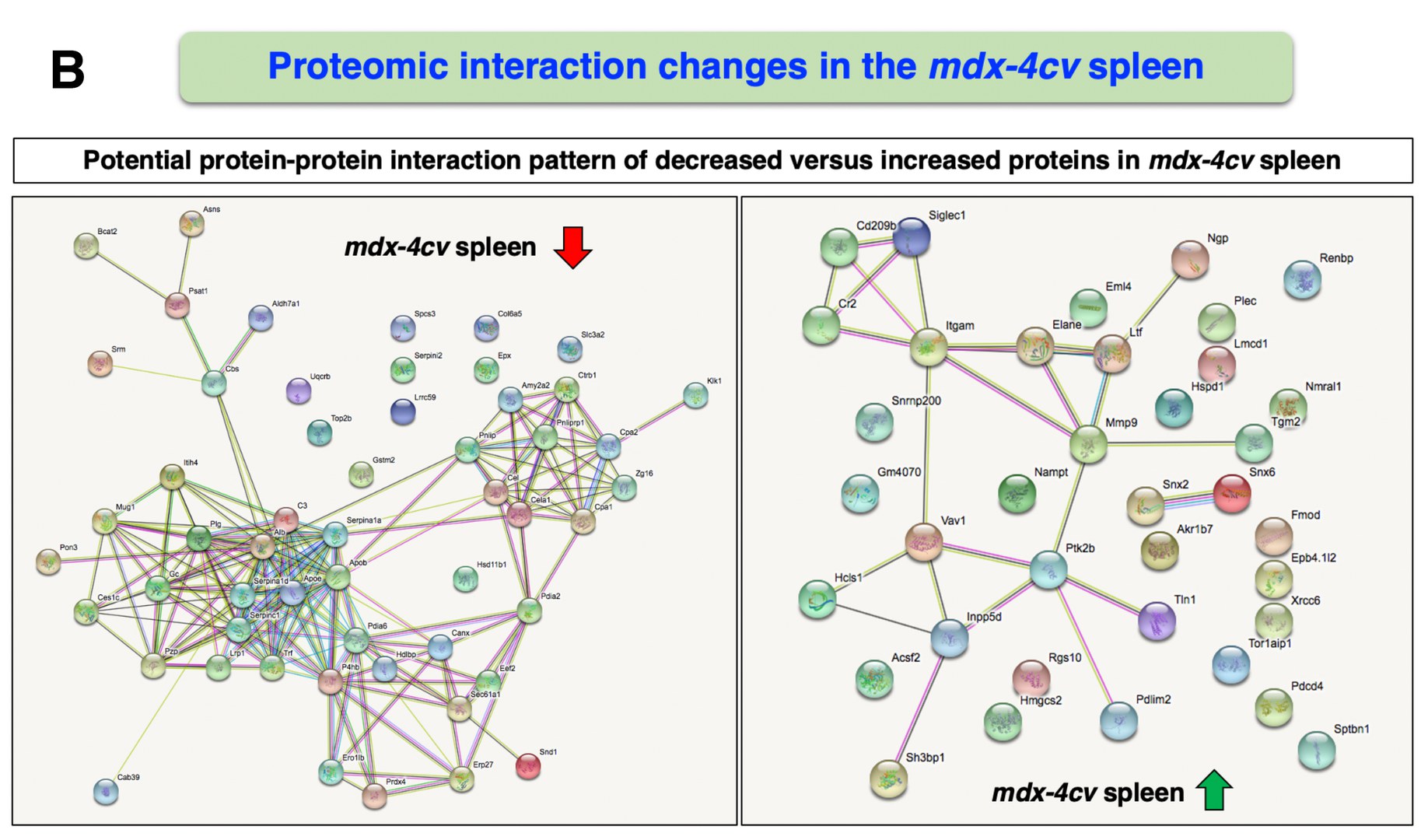
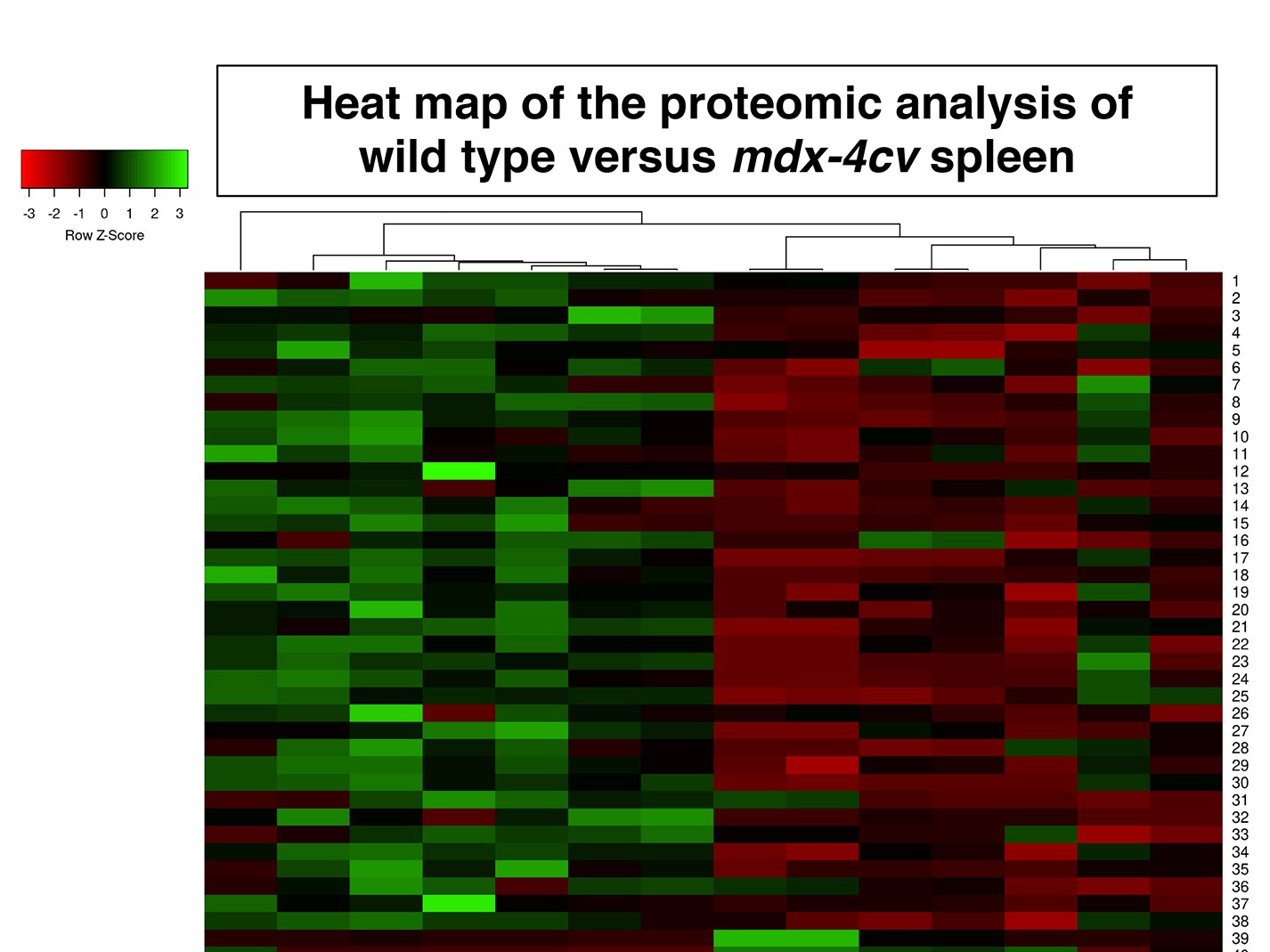
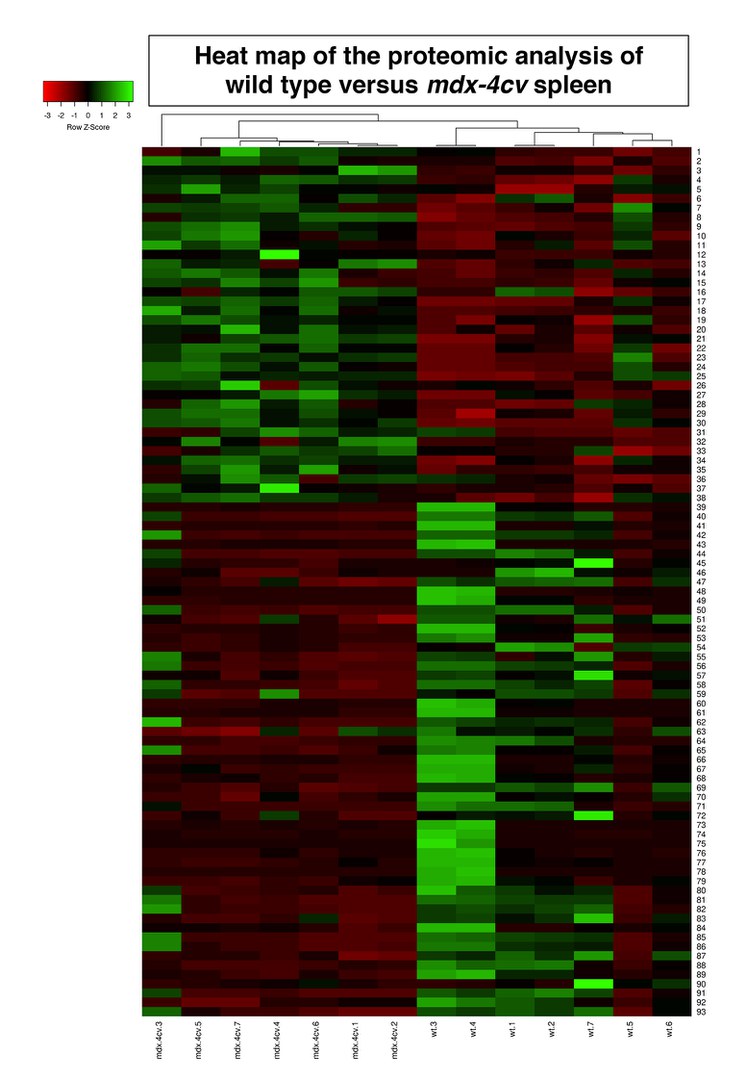
Anhand der Duchenne-Mäuse schlüsselten die Wissenschaftler erstmals die Gesamtheit der Proteine (Proteom) der Milz im Vergleich zu gesunden Kontrolltieren auf und erstellten ein umfassendes Proteinarchiv für dieses Organ. „In den Mäusen mit der Duchenne-Erkrankung wurden zahlreiche Änderungen der proteomischen Signatur der Milz im Vergleich zu den Kontrollen gefunden“, sagt Prof. Kay Ohlendieck von der National University of Ireland, Maynooth.
Darüber hinaus fanden die Wissenschaftler erstmals eine kürzere Form des Dystrophins (DP71), das in der Milz als Protein synthetisiert wird. „Diese Dystrophinvariante wird offensichtlich vom Krankheitsgeschehen nicht betroffen, weil sie in den Duchenne-Mäusen unverändert vorkommt“, sagt Swandulla. Der „Crosstalk“ drücke sich insbesondere dadurch aus, dass eine Vielzahl von Proteinen in der Milz durch den Verlust der langen Dystrophin-Form drastisch reduziert ist. „Dazu gehören Proteine, die am Lipidtransport und -metabolismus sowie an der Immunantwort und am Entzündungsgeschehen beteiligt sind.“
Folgeeffekte im lymphatischen System
Weiterhin liefert die Studie Hinweise darauf, dass der Verlust der langen Form des Dystrophins, wie er bei Duchenne im Skelettmuskel auftritt, offensichtlich Folgeeffekte im lymphatischen System hervorruft. „Es handelt sich dabei um einen echten `Crosstalk´ zwischen Skelettmuskulatur und lymphatischem System“, sagt Erstautor Dr. Paul Dowling von der Maynooth University.
Unter dem Begriff „Crosstalk“ ist etwa zu verstehen, wenn es am Telefon zu einer störenden Überlagerung eines weiteren Gesprächs kommt, das im Hintergrund zu hören ist. Im konkreten Fall der Duchenne-Muskeldystrophie drückte sich der „Crosstalk“ insbesondere dadurch aus, dass die Kurzform des Dystrophins in der Milz zwar weiterhin normal produziert wurde, es aber bei den anderen Proteinspezies zu störenden Veränderungen der proteomischen Signatur kam.
Die Wissenschaftler weisen darauf hin, dass die Ergebnisse der Studie nahelegen, dass die Mechanismen der Entzündungsprozesse, die im Laufe der Duchenne-Muskeldystrophie entstehen, ein besonderes Augenmerk verdienen. Denn diese entzündlichen Mechanismen sind ein wichtiges Kennzeichen der Muskelfaserdegeneration und tragen wesentlich zum Fortschreiten der Erkrankung bei. „Die spezifischen Wechselwirkungen des Dystrophinmangels mit dem Immunsystem könnten so neue Ansätze zur Therapie eröffnen“, sagt Prof. Swandulla.
Publikation: Paul Dowling, Stephen Gargan, Margit Zweyer, Michael Henry, Paula Meleady, Dieter Swandulla and Kay Ohlendieck: Proteome-wide changes in the mdx-4cv spleen due to pathophysiological crosstalk with dystrophin-deficient skeletal muscle, iScience, DOI: 10.1016/j.isci.2020.101500
Kontakt für die Medien:
Prof. Dr. Dieter Swandulla
Institut für Physiologie
Universität Bonn
E-Mail: swandulla@uni-bonn.de
Prof. Dr. Kay Ohlendieck
Department of Biology
Maynooth University
E-Mail: kay.ohlendieck@mu.ie