Die Forschenden kamen der Erbanlage auf die Spur, als sie zwei Personen mit angeborenen Fehlbildungen untersuchten. „Es handelte sich um einen Mann und seine Nichte“, erklärt Dr. Gabriel Dworschak. „Bei beiden waren Nieren, Harntrakt und Speiseröhre fehlgebildet, bei dem Mann zudem noch der rechte Arm und das Herz.“
Der Arzt der Universitätskinderklinik Bonn forscht an den Instituten für Anatomie und für Humangenetik an seltenen genetischen Erkrankungen. Als das Team die Erbanlagen der Familienmitglieder unter die Lupe nahm, stieß es auf eine Auffälligkeit: Bei den Betroffenen war im Vergleich zu den Gesunden ein Gen namens SHROOM4 verändert.
SHROOM4 war bereits aus einem anderen Zusammenhang bekannt: Man wusste, dass es unter anderem für die Funktion des Gehirns eine Schlüsselrolle spielt. Ist es mutiert, können Intelligenzdefizite, epileptische Anfälle und Verhaltensauffälligkeiten die Folge sein. „Unsere Befunde wiesen aber auch darauf hin, dass es eine breitere Rolle bei der embryonalen Organentwicklung spielen könnte“, erklärt Dworschak.
Das Bonner Team fahndete international nach anderen Fällen, bei denen ebenfalls Auffälligkeiten im SHROOM4-Gen gefunden worden waren – mit Erfolg: „Wir sind dadurch zusammen mit unseren Kooperationspartnern auf vier weitere Betroffene aus drei Familien gestoßen“, sagt Prof. Dr. Heiko Reutter, der inzwischen vom Uniklinikum Bonn an die Universität Erlangen-Nürnberg gewechselt ist. „Bei allen war das SHROOM4-Gen verändert, allerdings nicht immer in derselben Weise.“
Zebrafisch benötigt SHROOM4 ebenfalls
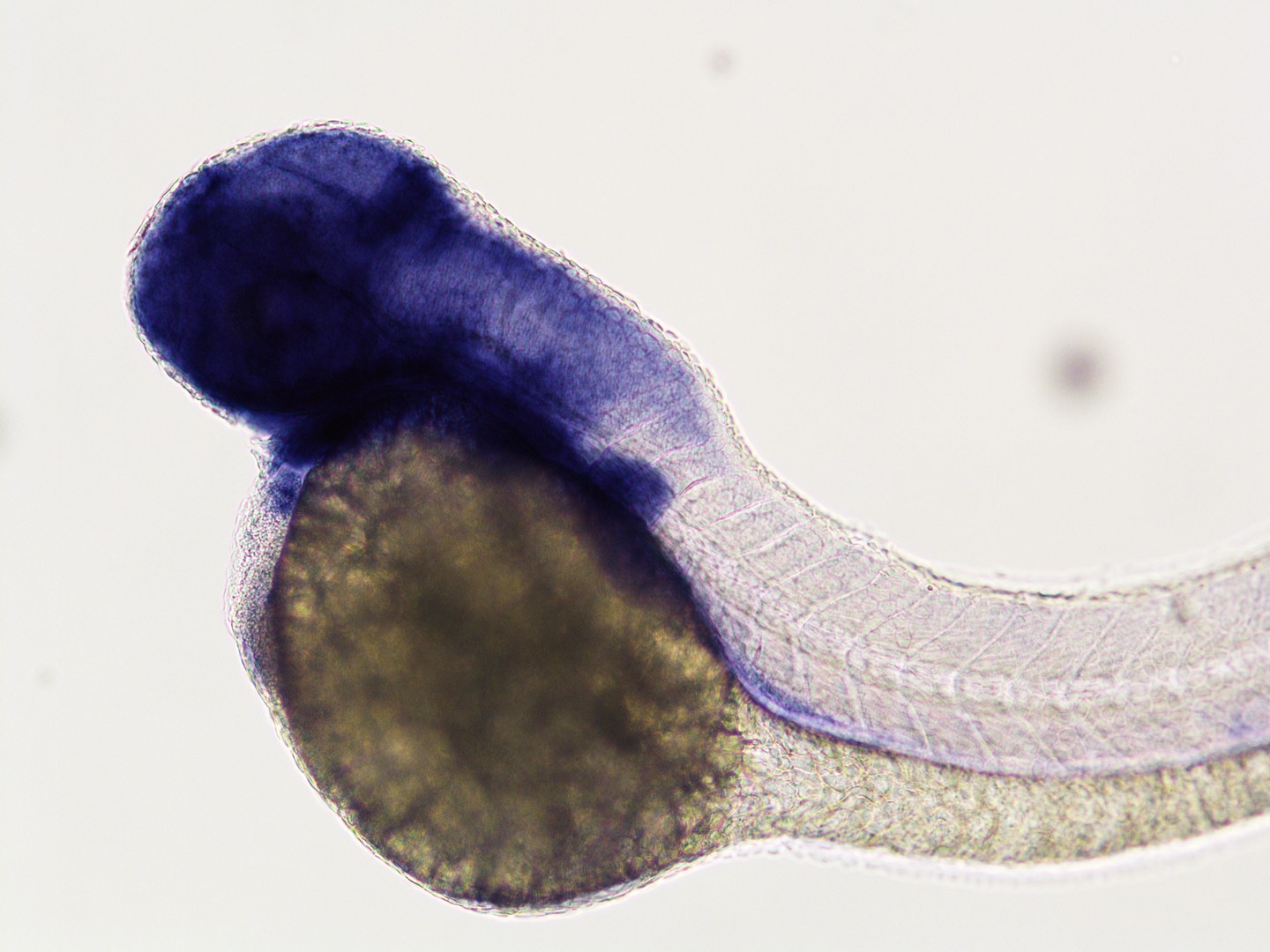
Damit war aber noch nicht zwingend geklärt, ob tatsächlich die SHROOM4-Varianten für die Fehlbildungen verantwortlich waren. Es gibt jedoch ein Tier, das über eine ganz ähnliche Erbanlage verfügt: der Zebrafisch. Er dient in vielen genetischen Studien heute als Modellorganismus – nicht nur, weil er sich einfach artgerecht halten und schnell vermehren lässt: Die Haut seiner Larven ist nahezu durchsichtig. Man kann also unter dem Lichtmikroskop leicht erkennen, wie sich die Tiere entwickeln. „Wir haben hier am Uniklinikum den Vorteil, dass die Arbeitsgruppe um Prof. Dr. Benjamin Odermatt vom Institut für Neuroanatomie sehr viel mit Zebrafischen arbeitet“, betont Dr. Caroline Kolvenbach, die ebenfalls an der Untersuchung von SHROOM4 beteiligt war. „Diese Expertise kam uns in unserer Studie zugute.“
Die Forschenden inaktivierten SHROOM4 in den Larven weitgehend. Die Tiere zeigten daraufhin ähnliche Fehlbildungen, wie sie auch bei den Patientinnen und Patienten zu beobachten waren. Bekamen Larven mit ausgeschaltetem SHROOM4 dagegen die intakte menschliche Erbanlage injiziert, wuchsen sie nahezu normal heran. „Das zeigt erstens, dass sie für eine gesunde Entwicklung ein funktionsfähiges SHROOM4 zwingend benötigen und zweitens, dass das menschliche Gen die Funktion des Fischgens noch übernehmen kann“, betont Dworschak.
Das Team möchte nun herausfinden, wie die Erbanlage in die Embryonalentwicklung eingreift. „Wir gehen davon aus, dass es für sehr grundlegende Prozesse in der Zelle benötigt wird“, sagt Dworschak. „Anders lässt sich kaum erklären, warum Veränderungen in ein und demselben Gen so unterschiedliche Symptome verursachen.“
Kleiner Mosaikstein zu einem extrem komplexen Bild
Wie aus einer befruchteten Eizelle eine Maus, ein Hund oder ein Mensch entsteht, ist bis heute nicht vollständig verstanden. Denn die Eizelle hat die Fähigkeit, jeden Gewebetyp im Organismus zu bilden, egal ob Knochen, Haut, Muskulatur oder das Gehirn. Ihre Tochterzellen sind genetisch mit ihr identisch; im Prinzip sollten sie das also auch können. Doch in ihnen werden sehr früh bestimmte Programme im Erbgut aktiviert, die ihren Werdegang unabänderlich festlegen.
Dieser Prozess muss bis ins Feinste koordiniert ablaufen. Denn nur dann ist sichergestellt, dass sich an der passenden Stelle des Gesichts die Augen bilden, während sich andere Zellen ganz in der Nähe zum Nasenknorpel differenzieren. Erstaunlicherweise gibt es aber keinen Dirigenten, der dabei den Taktstock schwingt. Es ist, als würde sich ein Lego-Raumschiff von selbst zusammenbauen – nur unendlich komplizierter. „Unsere Studie ist ein kleiner Mosaikstein zu diesem Bild, das noch weitgehend unvollständig ist“, sagt Dworschak.