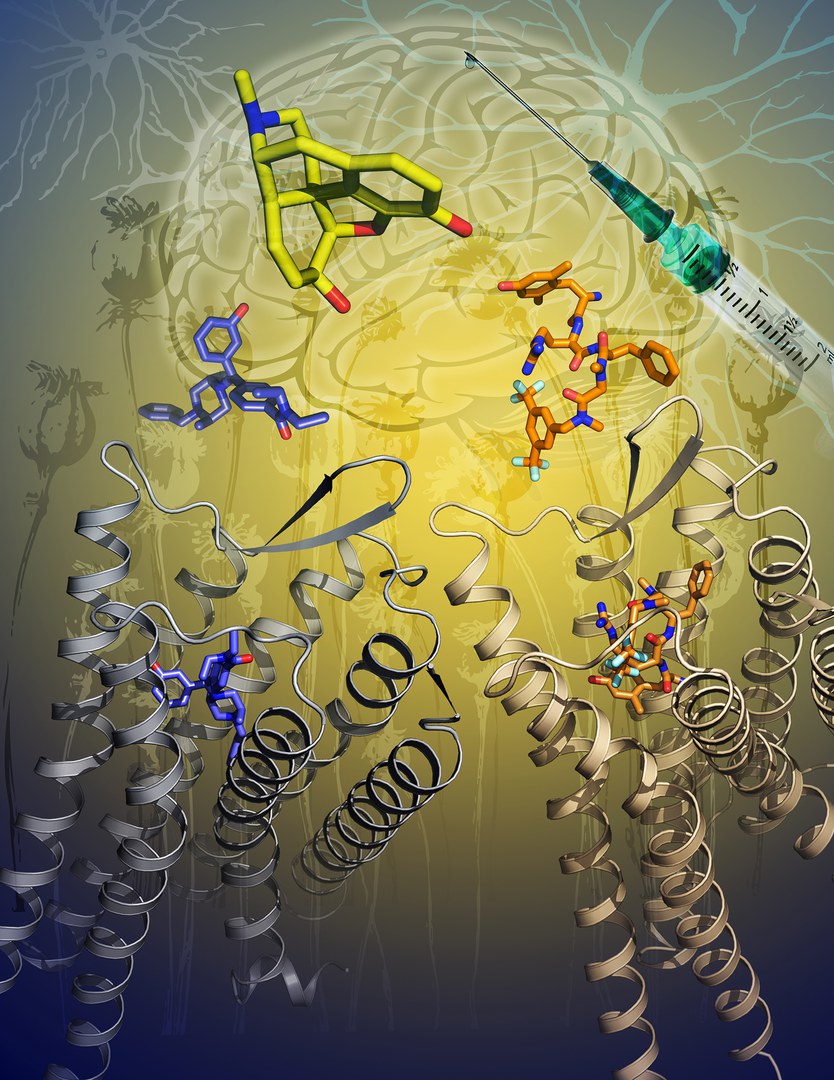
Opioide zählen zu den wirksamsten heute verfügbaren Schmerzmitteln. Dazu gehören beispielsweise Morphium oder auch Oxycodon, das früher in den USA oft sehr leichtfertig verschrieben wurde. Mit gravierenden Konsequenzen: Hunderttausende von Patienten wurden abhängig; viele von ihnen landeten später bei Drogen wie Heroin oder Fentanyl.
Oxycodon bindet im Körper an so genannte Opioid-Rezeptoren. Davon gibt es drei verschiedene Typen – MOP, DOP und KOP. Die bislang verfügbaren Schmerzmittel aktivieren vor allem die M-Form (auch µ-Rezeptor genannt). Die Stimulierung von MOP kann aber nicht nur süchtig machen, sondern zusätzlich lebensgefährliche Nebenwirkungen haben. Die wohl schwerwiegendste ist die Lähmung des Atemzentrums. Die häufigste Todesursache nach Heroin-Konsum ist denn auch Atemstillstand.
„Arzneistoffe, die selektiv an den DOP-Rezeptor binden, haben diese drastischen Nebenwirkungen vermutlich nicht“, hofft Prof. Dr. Christa Müller vom Pharmazeutischen Institut der Universität Bonn. Die Betonung liegt auf „selektiv“: Die Opioid-Rezeptoren sind einander so ähnlich, dass viele Wirkstoffe alle drei Formen aktivieren. Um Substanzen zu finden, die ganz spezifisch nur an den DOP-Rezeptor andocken, muss man daher exakt wissen, was bei der Bindung genau passiert.
Räumliche Struktur bis auf Atomebene sichtbar gemacht
Diese Frage kann die aktuelle Studie nun beantworten. „Wir haben den DOP-Rezeptor mit zwei verschiedenen Molekülen aktiviert, den Komplex aufgereinigt und dann seine Struktur mit Röntgenstrahlung aufgeklärt“, erklärt Tobias Claff, der den Hauptteil der Experimente durchgeführt hat. Dazu wird der Komplex aus Rezeptor und Wirkstoff in einen kristallinen Zustand überführt. Das Kristallgitter lenkt das Röntgenlicht auf charakteristische Weise ab. Aus der Intensitäts-Verteilung der gebeugten Strahlung lässt sich daher auf die räumliche Struktur des Komplexes schließen – und zwar bis hin zur Anordnung jeden einzelnen Atoms.
„Wir konnten so zeigen, welche Teile des Rezeptors für die Bindung der Wirkstoffe verantwortlich sind“, sagt Claff. „Mit diesem Wissen sollte es nun möglich sein, ganz gezielt neue Substanzen herzustellen, die ausschließlich DOP aktivieren.“ Das Interesse an solchen Pharmaka ist groß – auch deshalb, weil der DOP-Rezeptor anders als sein MOP-Pendant nicht vor allem gegen akute, sondern gegen chronische Schmerzen wirkt. Diese sind bislang nur sehr schwer zu therapieren.
Die Röntgenkristallografie ist kein neues Verfahren. Die Struktur so genannter G-Protein-gekoppelter Rezeptoren (dazu gehören auch die Opioid-Rezeptoren) ließ sich so aber bis vor kurzem nicht aufklären. Diese Membranproteine sitzen in dem dünnen fettähnlichen Häutchen, das den Zellinhalt wie eine Art Beutel umschließt. Aufgrund ihrer Fettlöslichkeit müssen sie während der Kristallisation aufwändig stabilisiert werden. Ansonsten denaturieren sie und ändern dadurch ihre räumliche Struktur. „Es gibt weltweit nur wenige Laboratorien, die diese Probleme beherrschen“, betont Christa Müller.
An der Universität Bonn können angehende Pharmazeuten während ihres Masters oder Staatsexamens ins Ausland gehen. Das Institut verfügt dazu über ein breites Netz von Kooperationspartnern – eine Tatsache, die etwa auch im Studien-Ranking des CHE regelmäßig sehr positiv bewertet wird. Tobias Claff nutzte diese Möglichkeit: „Ich habe ein Jahr meines Masters an einem Institut der ShanghaiTech University verbracht“, erklärt er. „Dort hat man in den letzten Jahren die Kristallografie von Membranproteinen entscheidend vorangetrieben.“ In Shanghai erlernte Claff die aufwändige Methode – ein Know-how, von dem nun auch seine Heimatuni profitiert, an die er inzwischen zurückgekehrt ist.
Dass sich ein Master-Student ein solch schwieriges Problem vorknöpfe, komme nicht häufig vor, betont Prof. Müller. „Dieser Erfolg ist eine ganz außergewöhnliche Leistung“, sagt sie. „Er zeigt zudem auch, wie gut die Fachgruppe Pharmazie mit ihrem internationalen Austauschprogramm aufgestellt ist.“
Publikation: Tobias Claff, Jing Yu, Véronique Blais, Nilkanth Patel, Charlotte Martin, Lijie Wu, Gye Won Han, Brian J. Holleran, Olivier Van der Poorten, Michael A. Hanson, Philippe Sarret, Louis Gendron, Vadim Cherezov, Vsevolod Katritch, Steven Ballet, Zhi-Jie Liu, Christa E. Müller, Raymond C. Stevens: Elucidating the active delta-opioid receptor crystal structure with peptide and small molecule agonists. Science Advances, DOI: 10.1126/sciadv.aax9115
Kontakt:
Prof. Dr. Christa E. Müller
Pharmazeutisches Institut der Universität Bonn
Abteilung für Pharmazeutische und Medizinische Chemie
Tel. 0228/732301
E-Mail: christa.mueller@uni-bonn.de