Die Forscher haben in ihrer Studie die Hirnentwicklung von Mäuse-Embryonen unter die Lupe genommen. Sie konzentrierten sich dabei auf einen Pool neuronaler Vorläufer-Zellen, der sich etwa zehn Tage nach der Befruchtung im Hinterhirn entwickelt. Diese reifen zu Nervenzellen heran und migrieren dann zu anderen Regionen im entstehenden Hinterhirn. Auch beim Menschen finden in der frühen Hirnentwicklung vergleichbare komplexe Zellwanderungen statt. „Wie das Ganze funktioniert, ist aber noch kaum verstanden“, erklärt Prof. Dr. Sandra Blaess vom Institut für Rekonstruktive Neurobiologie der Universität Bonn.
Bekannt ist, dass ein Protein namens GLI3 etwas mit der Organisation des frühen Gehirns zu tun hat. Doch was genau ist in diesem Zusammenhang seine Funktion? Dieser Frage ist Erick Martinez-Chavez, Doktorand von Prof. Blaess, zusammen mit seiner Kollegin Claudia Scheerer sowie Dr. Andrea Wizenmann von der Universität Tübingen nachgegangen. Dazu schalteten die Wissenschaftler zunächst die GLI3-Produktion in Mäusen komplett ab. Tatsächlich war in den Embryonen daraufhin die Wanderung dieser Nervenzellen stark gestört.
Nun wiederholten die Forscher ihr Experiment, unterbanden die GLI3-Produktion aber lediglich in den sich entwickelnden Nervenzellen. Diese zeigten sich davon erstaunlich unbeirrt: Sie traten ganz normal den Weg in ihre Zielregionen an. GLI3 wird also nicht direkt benötigt, um ihnen Beine zu machen. „Seine Funktion muss woanders liegen“, betont Martinez-Chavez. Doch wo?
Fungiert eine Nervenbahn als „Schienenweg“?
Außerhalb des Gehirns und Rückenmarks, dem sogenannten zentralen Nervensystem, gibt es in Tieren noch zahllose weitere Nervenbahnen und Nervenzellen, die in ihrer Gesamtheit als peripheres Nervensystem bezeichnet werden. Sie sind beispielsweise für die Übermittlung elektrischer Impulse an die Muskulatur verantwortlich.
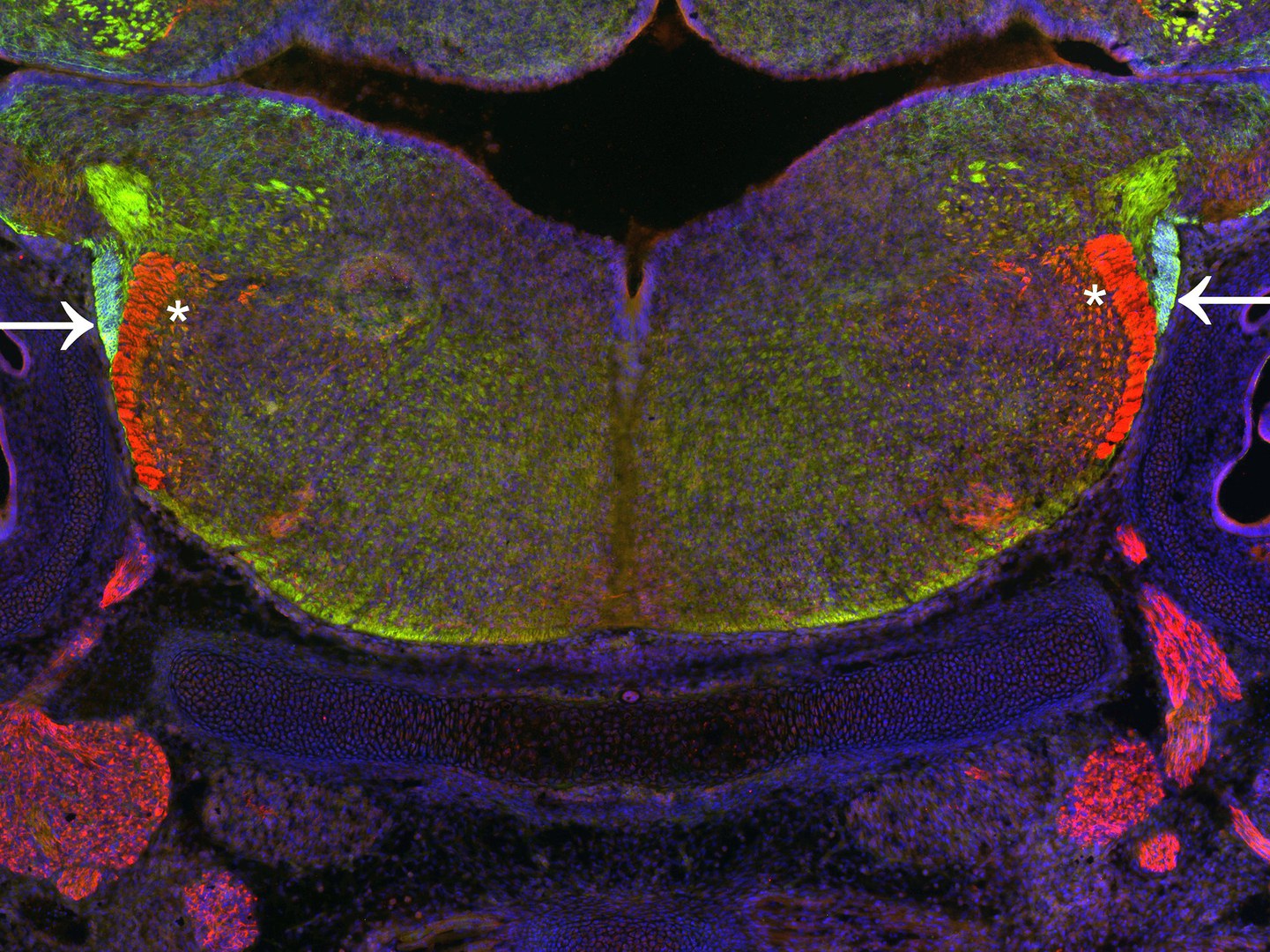
Obwohl periphere Nervenzellen außerhalb des Gehirns liegen, bilden diese auch Fortsätze aus, die ins Gehirn hinein reichen. Dies tun sie nicht einzeln, sondern in Form ganzer Bündel – ähnlich wie ein Kabelstrang in einem Computer. Hirnforscher sprechen dann von Nerventrakten.
Die Bonner Wissenschaftler konnten nun zeigen, dass sich ein Teil der Neurone bei der Wanderung zu ihrer Zielregion an einem dieser Trakte zu orientieren scheint: Die Zellen bewegen sich an ihm entlang, fast wie auf einer Schiene. Das klappte aber nur in Mäuse-Embryonen, die GLI3 produzierten. Wenn ihnen dagegen GLI3 fehlte, war die Bündelung der Nervenfortsätze viel lockerer als normal: Die Bahnen fransten gewissermaßen aus – eine Auffälligkeit, die im Mikroskopbild gut sichtbar wurde. „Wir vermuten, dass die Ausfransung der Nerventrakte zum Verlust ihrer Schienenfunktion führt“, sagt Prof. Blaess. Welche Funktion GLI3 dabei hat und welche Mechanismen die Interaktion zwischen Nervenzellen und Trakt regulieren, muss noch in weiteren Studien geklärt werden.
Die Ergebnisse könnten langfristig das Verständnis bestimmter Entwicklungsstörungen des Gehirns verbessern helfen. Vor allem aber erlauben sie einen faszinierenden Einblick in die Organisation unseres Denkorgans – und in die komplexen Vorgänge, die dazu ineinandergreifen müssen.
Publikation: Erick Martinez-Chavez, Claudia Scheerer, Andrea Wizenmann und Sandra Blaess: The zinc-finger transcription factor GLI3 is a regulator of precerebellar neuronal migration; Development; dx.doi.org/10.1242/dev.166033
Kontakt:
Prof. Dr. Sandra Blaess
Heisenberg-Professur für Entwicklungsneurobiologie
Institut für Rekonstruktive Neurobiologie
Universität Bonn
Tel. 0228/6885-540
E-Mail: sandra.blaess@uni-bonn.de