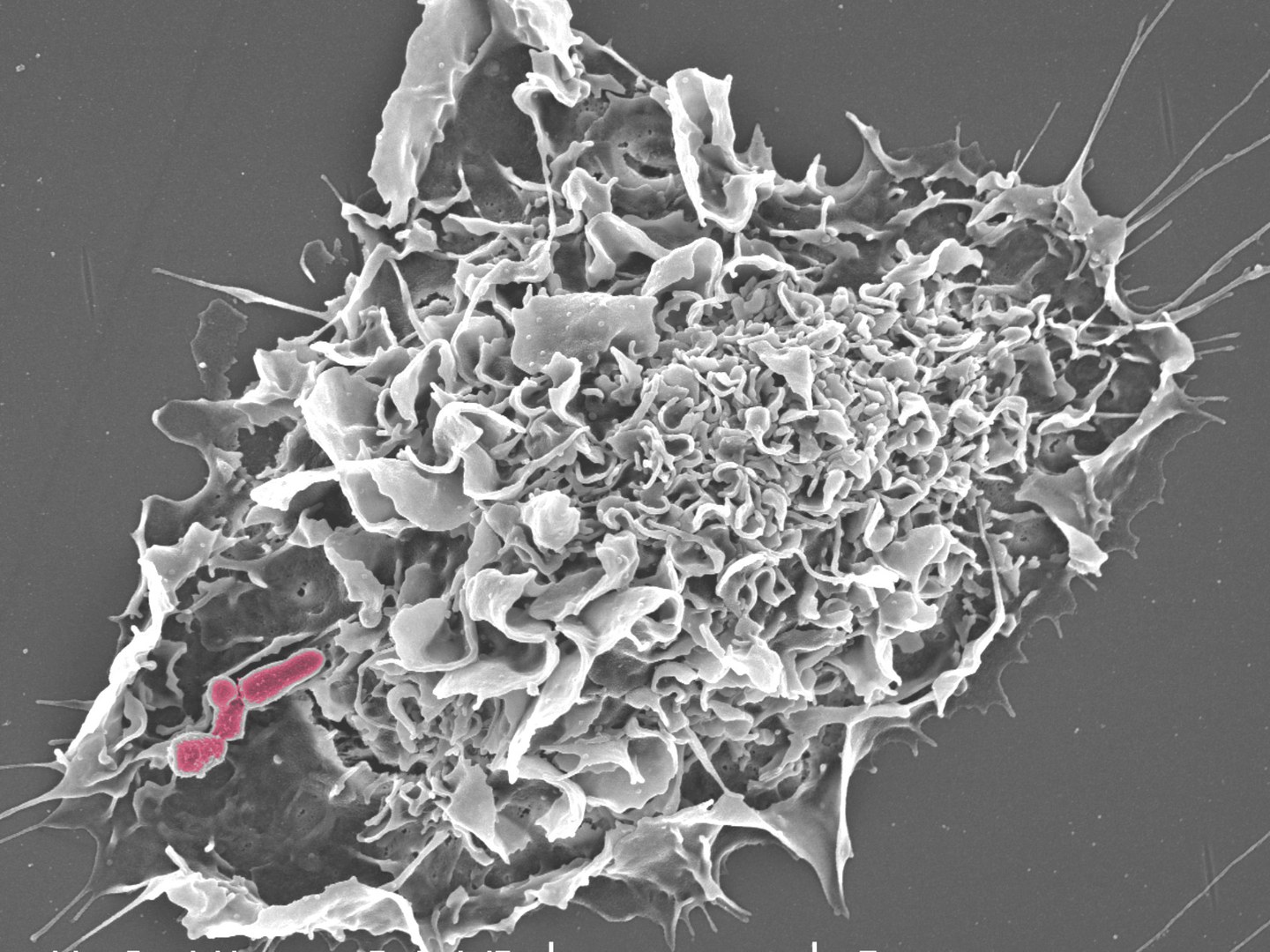
Unser Immunsystem wäre ohne Fresszellen, vor allem ohne die sogenannten Makrophagen, ziemlich wehrlos. Sie patrouillieren durch unseren Körper, sie nehmen nutzlos gewordene und gestorbene Körperzellen auf und verdauen sie. Auch eingedrungene Krankheitserreger sind auf dem Speiseplan. Sie werden von Fresszellen an typisch mikrobiellen Oberflächenstrukturen erkannt, die unserem Körper Gefahr signalisieren. Partikel werden aufgenommen, indem der Makrophage einen Teil der ihn umgebenden Membran um das Partikel stülpt und so die Beute aufnimmt. Den entstandenen Membransack nennt man das Phagosom (vom griechischen phagein = fressen).
Das Phagosom verändert sich im Makrophagen über die Zeit, indem zum Beispiel eine ‚Protonenpumpe‘ eingebaut wird, die das Innere des Phagosoms sauer macht. Nach ein paar Minuten verschmilzt das saure Phagosom mit einem anderen Membransack, dem Lysosom, das mehr als 50 Typen Verdauungsenzyme in das Phagosom entlässt. „Man kann sich das vorstellen wie ein Verdauungssystem, bei dem der Nährstoff im Phagosomenmagen sitzt und die Enzyme aus der lysosomalen Verdauungsdrüse ins Phagosom geschossen werden“, sagt Professor Dr. Albert Haas vom Institut für Zellbiologie der Universität Bonn. „Diesen Verdauungsprozess haben wir von amöbenartigen Zellen geerbt, die ihn vor vielen Millionen Jahren evolviert haben. Mit seiner Hilfe konnten sie sich von herumschwimmenden Bakterien ernähren.“
Hauptverursacher der oft tödlich verlaufenden Pneumonie bei Fohlen
Das Ende der Mikrobe ist nach der Verschmelzung von Phagosom und Lysosom meist nahe – es sei denn, es handelt sich um einen sogenannten intrazellulären Krankheitserreger, der sich darauf spezialisiert hat, in Säugerzellen zu überleben. Diese Krankheitserreger nutzen oft gezielt solche Säugerzellen zu ihrer Vermehrung aus, die eigentlich dazu da sind, sie zu eliminieren – wie eben Makrophagen. Rhodococcus equi, kurz R. equi, ist so ein Pathogen. Es ist ein sehr wichtiger veterinärmedizinischer Keim und der Hauptverursacher der oft tödlich verlaufenden Pneumonie bei Fohlen. Es verursacht aber auch schlimmste Lungeninfektionen bei AIDS-Patienten.
Unter der Federführung von Prof. Haas haben nun Forscher aus Deutschland und Norwegen einige der Kniffe entschlüsselt, mit denen R. equi die Makrophagen austrickst. Die Wissenschaftler zeigen, dass Rhodococcus ein Protein abgibt, das an die Phagosomenmembran bindet und dort den Einbau der Protonenpumpe hemmt. Außerdem führt das membrangebundene Protein namens VapA dazu, dass die Membran ein wenig löchrig wird. „Kleinste Substanzen, wie beispielsweise Protonen, können durch diese Öffnungen verloren gehen“, erläutert Prof. Haas.
So wird aus der angesäuerten Umwelt im Phagosom eine pH-neutrale. Aber damit nicht genug. VapA gelangt aus den Phagosomen in die Lysosomen. „Das ist ein sehr ungewöhnlicher intrazellulärer Transportweg, der bisher nicht erforscht ist“, so Haas. Das VapA-Protein macht auch die Lysosomenmembran löchrig und lässt ebenfalls Protonen herausfließen. So können die lysosomalen Verdauungsenzyme, die Säure brauchen, um zu funktionieren, ihre Arbeit nicht leisten, und das Bakterium bleibt unbehelligt. „Wenn wir das Innere der Lysosomen und Phagosomen mit pharmakologischen Substanzen neutralisieren, vermehren sich plötzlich auch harmlose Rhodokokken in Makrophagen“. Mit anderen Worten: Rhodokokken müssen nur viel VapA zur Neutralisation herstellen und sie können sich in den Fresszellen vermehren.
„Wir haben hier die Achillesferse von Rhodococcus gefunden“, schlussfolgert Prof. Haas. Pharmazeutika, die sich gegen diese VapA-Funktion richten, wären wahrscheinlich hervorragende Antibiotika während einer Rhodokokkeninfektion.
Publikation: von Bargen K., Scraba M., Krämer I., Ketterer M., Nehls C., Krokowski S., Repnik U., Wittlich M., Maaser A., Zapka P., Bunge M., Schlesinger M., Huth G., Klees A., Hansen P., Jeschke A., Bendas G., Utermöhlen O., Griffiths G., Gutsmann T., Wohlmann J., Haas A.: VapA from Rhodococcus equi is an inter-compartmental pH-neutralising virulence factor, „Cellular Microbiology“, DOI: https://doi.org/10.1111/cmi.12958
Kontakt für die Medien:
Prof. Dr. Albert Haas
Institut für Zellbiologie
Universität Bonn
Tel. 0228/736340
E-Mail: ahaas@uni-bonn.de