Daptomycin ist ein so genanntes Reserve- oder Notfall-Antibiotikum: Es gilt oft als letzte Rettung gegen multiresistente Bakterien wie zum Beispiel MRSA-Keime. Seit mehr als zehn Jahren ist die Substanz in Deutschland inzwischen zugelassen. Zu der Art und Weise, wie sie Bakterien tötet, gab es aber bislang verschiedene Hypothesen. „Es ist absolut ungewöhnlich“, betont Prof. Dr. Tanja Schneider vom Institut für Pharmazeutische Mikrobiologie der Universität Bonn: „Bei allen anderen zugelassenen Antibiotika kennen wir den Wirkmechanismus; bei Daptomycin tappen wir dagegen selbst nach Jahrzehnten intensiver Forschung noch weitgehend im Dunkeln.“
In dieses Dunkel bringen die Wissenschaftler mit ihrer Studie nun etwas Licht. Demnach hemmt Daptomycin mit einem trickreichen Mechanismus die Zellwand-Synthese der gefährlichen Erreger. An der Arbeit waren neben den Universitäten Bonn und Amsterdam auch die Ruhr-Universität Bochum, die Universität Newcastle und das Deutsche Zentrum für Infektionsforschung (DZIF) beteiligt.
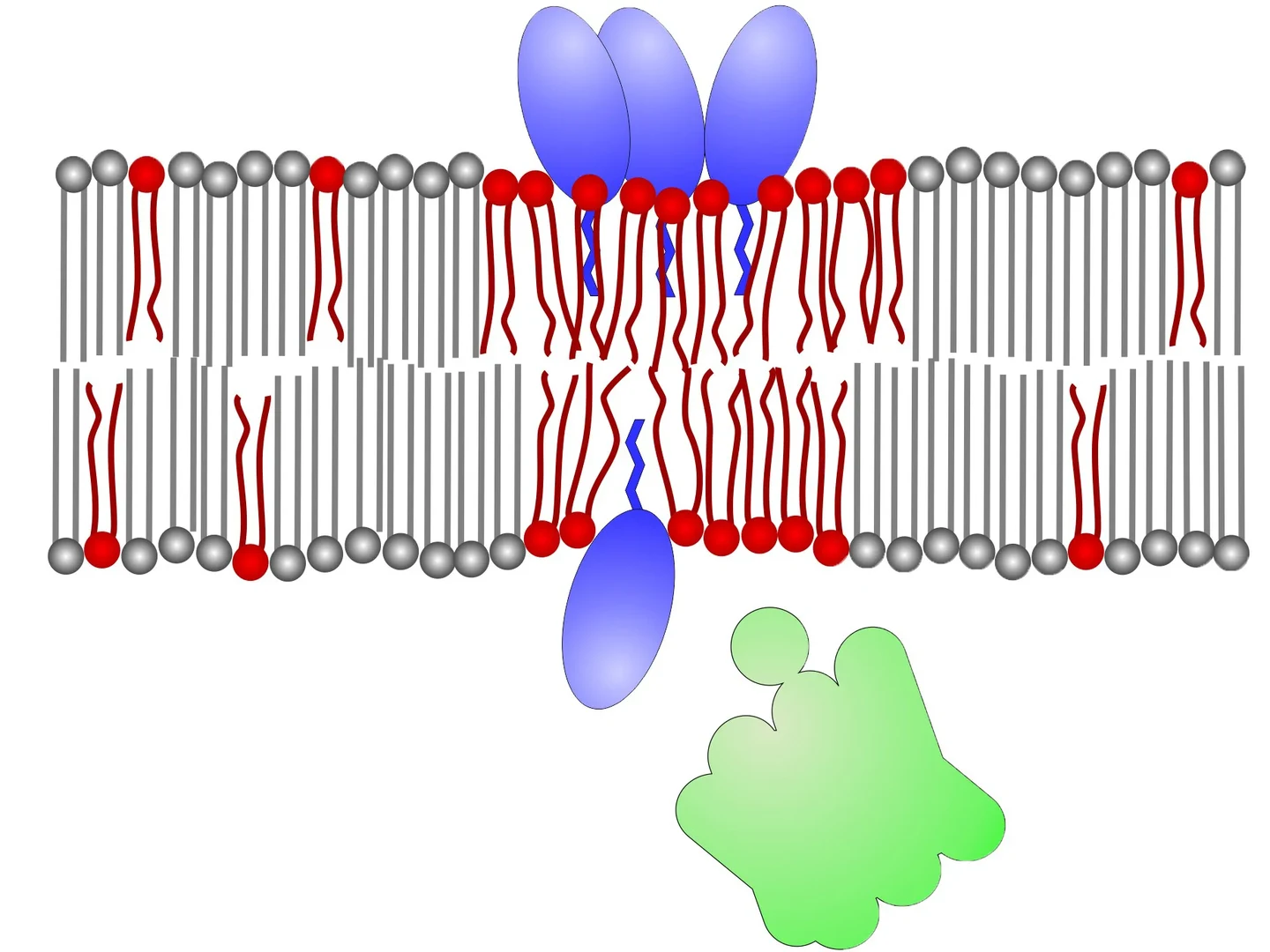
Bakterien sind von einer Membran umgeben, die der Haut einer Seifenblase ähnelt. In ihr sind zahlreiche Proteine eingebettet, die wichtige Aufgaben in der Zelle übernehmen. An die Membran schließt sich nach außen die feste Zellwand an.
Die Membran selbst ist dagegen relativ flexibel. Sie besteht aus Lipiden, einer Substanzgruppe, zu der auch Fette zählen. In Membranen gibt es verschiedene Lipid-Typen. Einige von ihnen haben eine chemische Struktur, die sie sehr beweglich macht – wie leichtflüssiges Öl. Andere sind dagegen zäh wie erkaltetes Fett. In der Bakterienmembran wechseln sich flüssigere mit festeren Bereichen ab. Die Anordnung dieser Bereiche ändert sich ständig – die Membran ist also ein sehr dynamisches System.
Magnet in der Zellmembran
Daptomycin bringt diesen Aufbau nun gründlich durcheinander. Das Antibiotikum ähnelt einer Kaulquappe mit einem dicken Kopf und einem kurzen Schwanz. Dieser Schwanz taucht in die Außenseite der Bakterienmembran ein. Dazu muss sich der Kopf Platz verschaffen und die Lipide etwas zur Seite schieben. „Das funktioniert augenscheinlich nur an bestimmten Stellen, an denen die Membran ausreichend fluide ist“, erklärt Prof. Schneider.
Daptomycin-Moleküle haben zudem unter bestimmten Bedingungen die Tendenz, sich aneinanderzulagern. Diese Aggregate benötigen besonders große flüssige Membranbereiche. Zu diesem Zweck ziehen sie – ähnlich wie ein Magnet – weitere leicht bewegliche Lipide an sich heran. Dadurch kommt es zu gravierenden Störungen der Membranstruktur. Proteine, die normalerweise an der Innenseite des Lipid-Häutchens befestigt sind, können sich lösen und ihre Funktion verlieren. „Darunter sind auch Enzyme, die den Aufbau der Bakterien-Zellwand katalysieren“, erklären Schneiders Mitarbeiter Dr. Anna Müller und Dr. Fabian Grein. „Ohne diese Schutzhülle gehen die Erreger zugrunde.“
Neben dem nun gefundenen Mechanismus vermuten die Wissenschaftler noch weitere, die zur antibakteriellen Wirkung von Daptomycin beitragen. Diese aufzuklären, ist Thema aktueller Forschungsarbeiten. Den genauen Wirkungsmechanismus eines Antibiotikums im Detail zu verstehen, sei enorm wichtig. „So können wir beispielsweise besser abschätzen, mit welchen anderen Antibiotika sich der Wirkstoff sinnvoll kombinieren lässt oder wie groß das Risiko einer Resistenzbildung ist“, betont Tanja Schneider.
Momentan wird Daptomycin nur in Fällen eingesetzt, in denen andere Antibiotika versagen – die Mediziner wollen nicht riskieren, dass MRSA-Keime durch unbedachte Nutzung gegen den Wirkstoff unempfindlich werden. Diese Gefahr besteht durchaus: Schon jetzt gibt es Bakterienstämme, die selbst gegen diese schlagkräftige Waffe resistent sind.
Publikation: Anna Müller, Michaela Wenzel, Henrik Strahl, Fabian Grein, Terrens N. V. Saaki, Bastian Kohl, Tjalling Siersma, Julia E. Bandow, Hans-Georg Sahl, Tanja Schneider, Leendert W. Hamoen: Daptomycin inhibits cell envelope synthesis by interfering with fluid membrane microdomains; PNAS; DOI: 10.1073/pnas.1611173113
Kontakt für die Medien:
Prof. Dr. Tanja Schneider
Institut für Pharmazeutische Mikrobiologie der Universität Bonn
Deutsches Zentrum für Infektionsforschung (DZIF)
Tel. 0228/735688 oder 735266
E-Mail: tschneider@uni-bonn.de