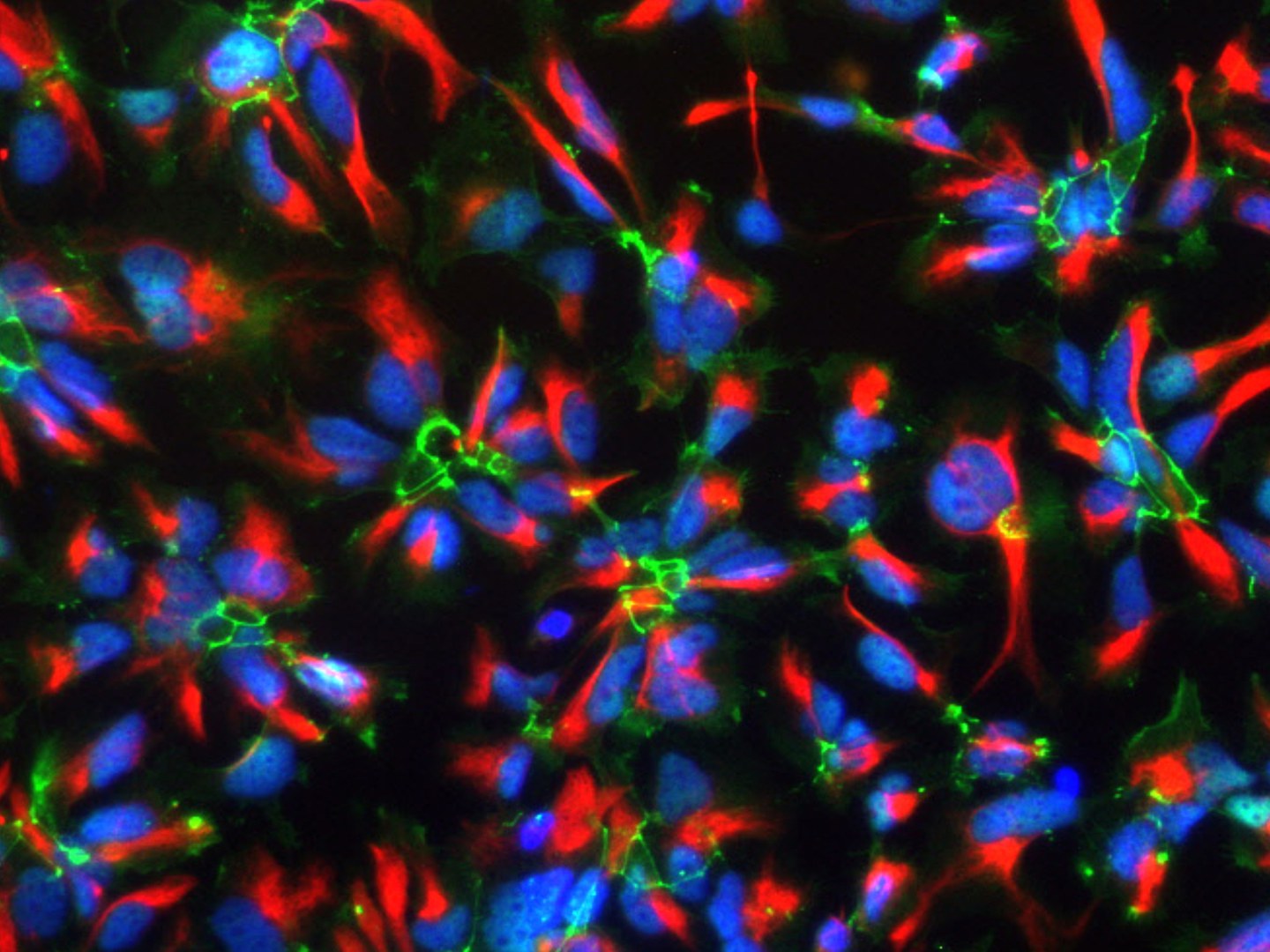
Schon wenige Tage nach Befruchtung der Eizelle beginnt im werdenden Kind die Entwicklung des Gehirns. Bis zur Geburt bilden sich hier im Schnitt jede Minute rund 250.000 neue Nervenzellen. Wenn der Säugling das Licht der Welt erblickt, warten in seinem Kopf rund 100 Milliarden dieser Neuronen auf Input.
Diese enorme Menge an Nervenzellen stammt von einigen wenigen Vorläuferzellen ab, den neuralen Stammzellen. Diese müssen sich zunächst vermehren, um genügend Ausgangszellen zu bilden. Nach und nach schlägt dann ein Teil der Zellen einen anderen Weg ein und beginnt, in die gewebespezifischen Zellen des Gehirns (Neurone und Gliazellen) auszureifen. Der Übergang zwischen Zellvermehrung und Ausreifung muss dabei genau austariert werden: Eine Veränderung des Gleichgewichtes hätte fatale Folgen und könnte zum Beispiel die Entstehung von Gehirntumoren auslösen. Um dies zu verhindern, wird das Schicksal der neuralen Stammzellen augenscheinlich äußerst strikt reguliert. Die Bonner Wissenschaftler haben nun einen dieser Regulationsmechanismen entschlüsselt.
Regelkreis für die Nervenproduktion
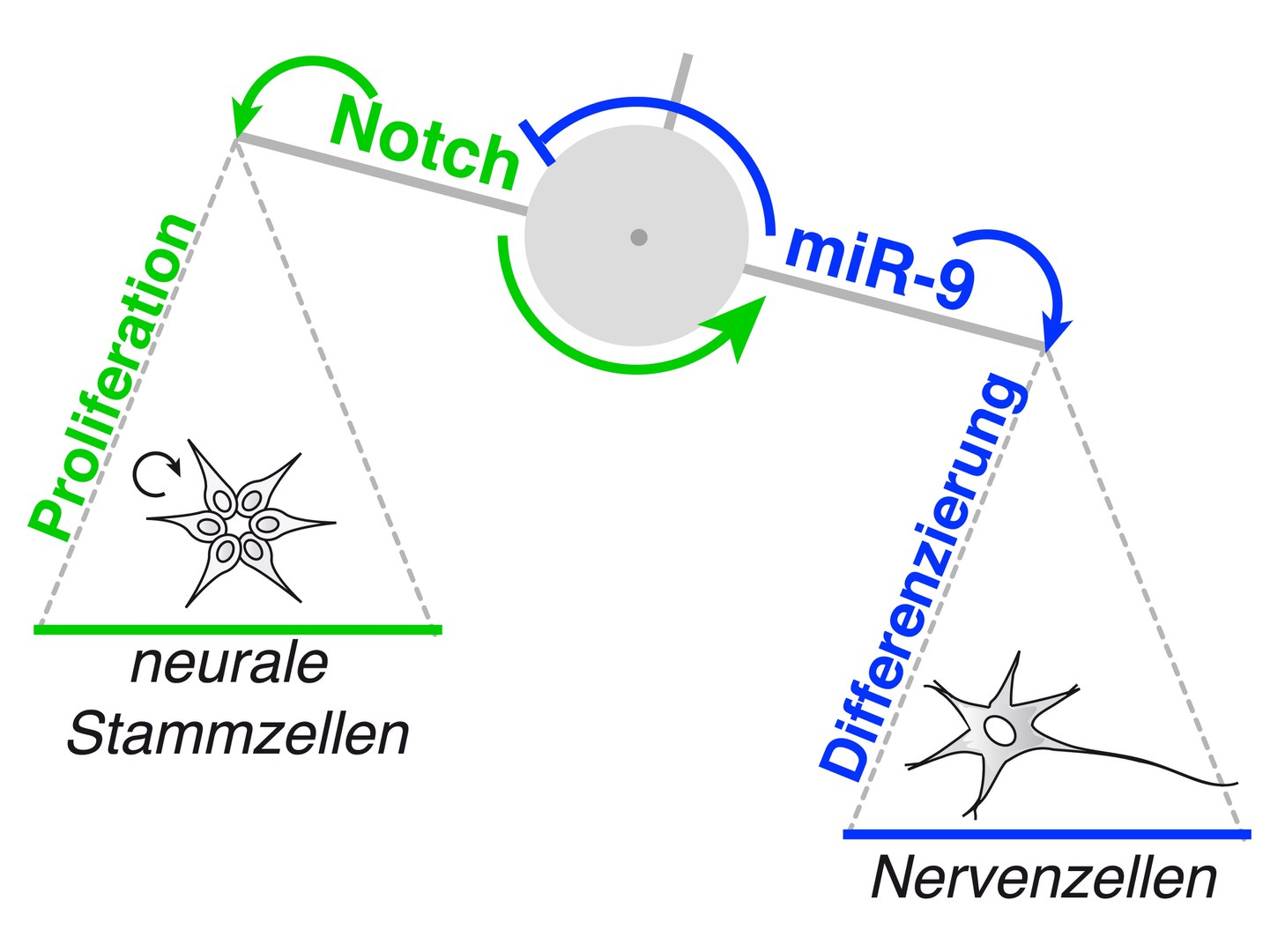
Für ihre Experimente nutzten sie neurale Stammzellen, aus denen sich menschliche Nervenzellen erzeugen lassen. „Wir konnten zeigen, dass an der Regulation dieser Zellen zwei verschiedene Komponenten beteiligt sind“, erklärt Dr. Laura Stappert vom Institut für Rekonstruktive Neurobiologie der Universität Bonn. Beide Komponenten kontrollieren sich quasi gegenseitig. Sie bilden so einen Regelkreis, der die Stammzell-Aktivität während der Gehirnentwicklung bis ins Feinste austariert.
Der eine Akteur in diesem Regelkreis ist der so genannte Notch-Signalweg. Er sorgt dafür, dass sich die Stammzellen munter vermehren. Gleichzeitig verhindert er, dass sich die Zellen spezialisieren, also in Neuronen oder Gliazellen umwandeln. Sie verbleiben in ihrem unreifen Zustand.
Gegenspieler des Notch-Weges ist ein Molekül mit dem kryptischen Namen miR-9/9*. Dieses unterbindet die Teilung der Stammzellen. Stattdessen sorgt es dafür, dass sie den Karrierepfad in Richtung Nervenzellen einschlagen. Zugleich hemmt miR-9/9* den Notch-Signalweg.
MiR-9/9* steht also für die Ausreifung und Differenzierung von Stammzellen, Notch für ihre Vermehrung. „Interessanterweise bewirkt Notch zusätzlich noch eine vermehrte Produktion von miR-9/9*“, erläutert Dr. Beate Roese-Koerner, die gemeinsam mit Stappert Erstautorin der Studie ist: „Notch erzeugt also seinen eigenen Hemmstoff.“
„Dieser Mechanismus verhindert augenscheinlich, dass sich die Stammzellen zu schnell teilen: Jedem Tritt aufs Gaspedal folgt direkt ein Tritt auf die Bremse“, ergänzt Professor Dr. Oliver Brüstle, Direktor des Instituts für Rekonstruktive Neurobiologie. Möglicherweise eignet sich miR-9/9* daher auch, um das Wachstum von Tumoren zu unterbinden. Die Forscher wollen diese These nun weiter untersuchen.
Die Bonner Wissenschaftler haben sich auf die Gewinnung von Nervenzellen aus Stammzellen spezialisiert. Sie setzen diese für den Zellersatz im Gehirn ein. Dazu müssen sie genau wissen, auf welche Weise der Ausreifungsprozess kontrolliert wird. Neu identifizierte Regulationsfaktoren wandern direkt in die Werkzeugkiste der Forscher, da sie noch mehr Kontrolle über die Zellen erlauben. Die neuen Erkenntnisse sind in diesem Zusammenhang von großer Relevanz.
Publikation: Roese-Koerner et al., Reciprocal Regulation between Bifunctional miR-9/9* and its Transcriptional Modulator Notch in Human Neural Stem Cell Self-Renewal and Differentiation, Stem Cell Reports (2016), http://dx.doi.org/10.1016/j.stemcr.2016.06.008
Kontakt:
Institut für Rekonstruktive Neurobiologie der Universität Bonn
Dr. Laura Stappert
Telefon: 0228/6885-533
E-Mail: laurastappert@uni-bonn.de
Prof. Dr. Oliver Brüstle
Telefon: 0228/6885-500
E-Mail: r.neuro@uni-bonn.de